Как определить теплоёмкость газа при постоянном давлении

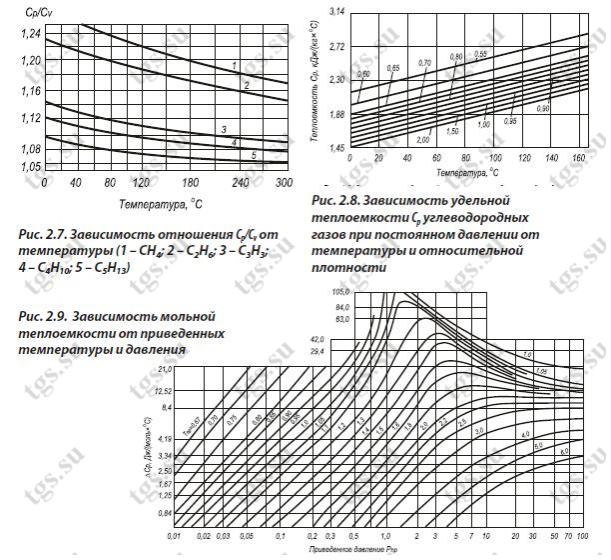
Таблица удельной теплоемкости газов
Молярная теплоёмкость — теплоёмкость 1 моля вещества [2] :. Формула расчёта удельной теплоёмкости [1] [2] :. При изменении объёма газу передаётся или отбирается некоторое количество тепла [3]. Первое Начало Термодинамики для изохорного процесса имеет вид [1] :. Уравнение Майера вытекает из первого начала термодинамики [4] :. Учитываем, что работа газа равна [4] :.


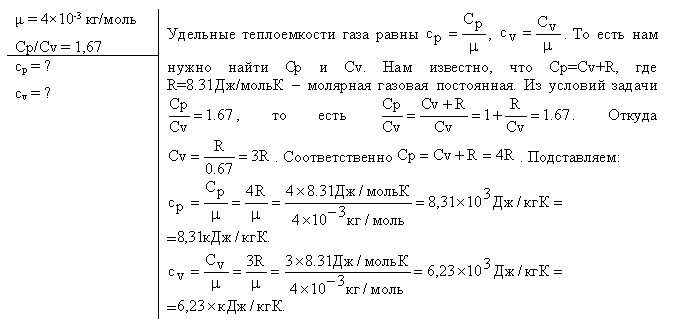




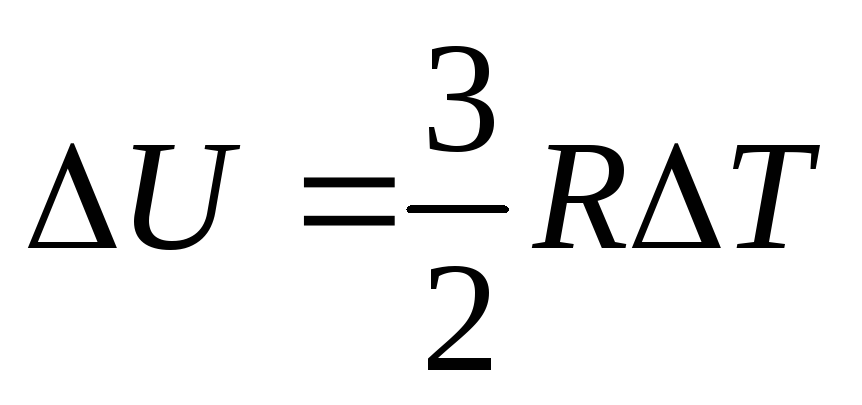

Форум сайта alsak. Добро пожаловать, Гость. Пожалуйста, войдите или зарегистрируйтесь. Не получили письмо с кодом активации? Начало www. МКТ » Термодинамика » Определить удельную теплоёмкость газа при постоянном давлении.
- Понятие теплоемкости
- Теплота — это величина, характеризующая энергию тела, которая передается другому телу в процессе теплообмена. Передача теплоты может происходить различными путями, включая кондукцию, конвекцию и излучение.
- В случае, если результатом теплообмена становится передача телу некоего количества теплоты Q , то его температура и внутренняя энергия претерпевают изменения.
- Цель работы: определить методом Клемана-Дезорма отношение теплоемкостей воздуха при постоянном давлении и постоянном объеме.
- Вспомним еще раз: для того, чтобы что-нибудь заставить совершать работу, это что-то надо заставить двигаться.
- Молярная теплоёмкость — это физическая величина, которая характеризует способность вещества поглощать или отдавать тепловую энергию при изменении температуры на единицу при постоянном давлении или объёме. Она определяется как количество тепла, необходимое для изменения температуры одного моля вещества на один градус.
- Удельная теплоемкость является важной характеристикой газов, она определяет количество тепла, которое необходимо передать единице массы газа для изменения его температуры на определенную величину.
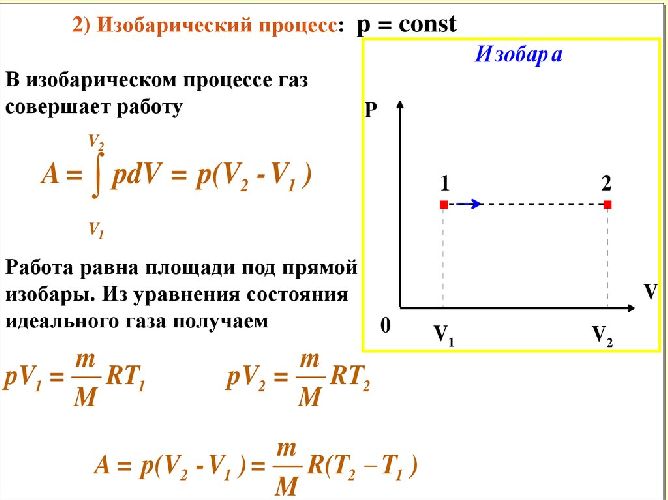
- При введении понятия теплоемкости мы не обращали внимание на одно существенное обстоятельство: теплоемкости зависят не только от свойств вещества, но и от процесса, при котором осуществляется теплопередача. Если нагревать тело при постоянном давлении, то оно будет расширяться и совершать работу.
- Строго запрещено смотреть анал видео. Крутые - все самые шикарные мамки видео.
- Понятие теплоемкости рассмотрено в разделе 3. Применим это понятие для газов, систематизируя разновидности теплоемкостей.

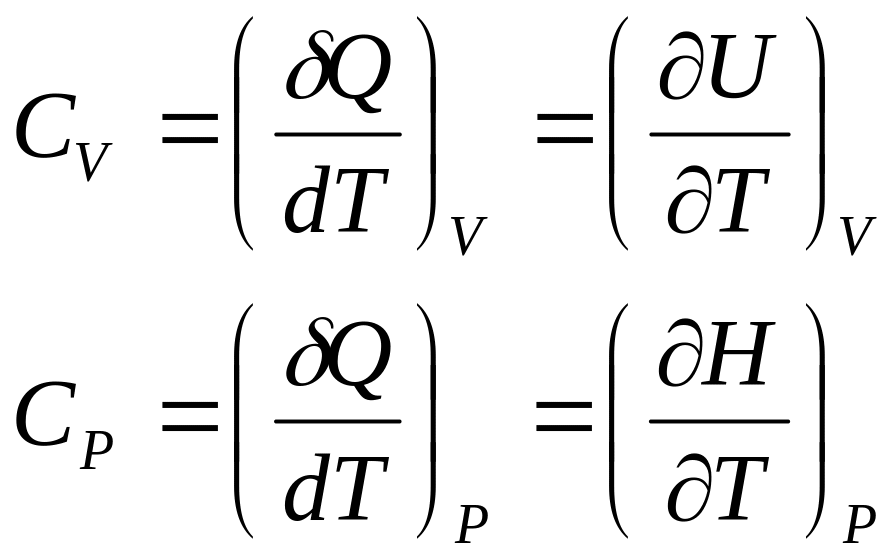




Соотношение Майера или уравнение Майера [1] , или соотношение Роберта Майера [2] — это уравнение, связывающее теплоёмкость идеального газа при постоянном давлении с его теплоёмкостью при постоянном объёме. Для газа, взятого в количестве одного моля , соотношение Майера имеет вид:. Это соотношение впервые было обосновано в году немецким исследователем Юлиусом Робертом Майером [3] [4] , а более подробно и доказательно — в его научной публикации года «Органическое движение в его связи с обменом веществ» нем. В частном случае изохорного процесса при неизменном объёме тела работа равна нулю, то есть. В то же время при изобарном процессе при постоянном давлении количество теплоты, необходимое, чтобы повысить температуру на такую же величину d T. В соответствии с законом Джоуля , внутренняя энергия заданного количества идеального газа зависит только от его температуры, поэтому изменение его внутренней энергии при любом процессе выражается через изменение его температуры согласно формуле 2.
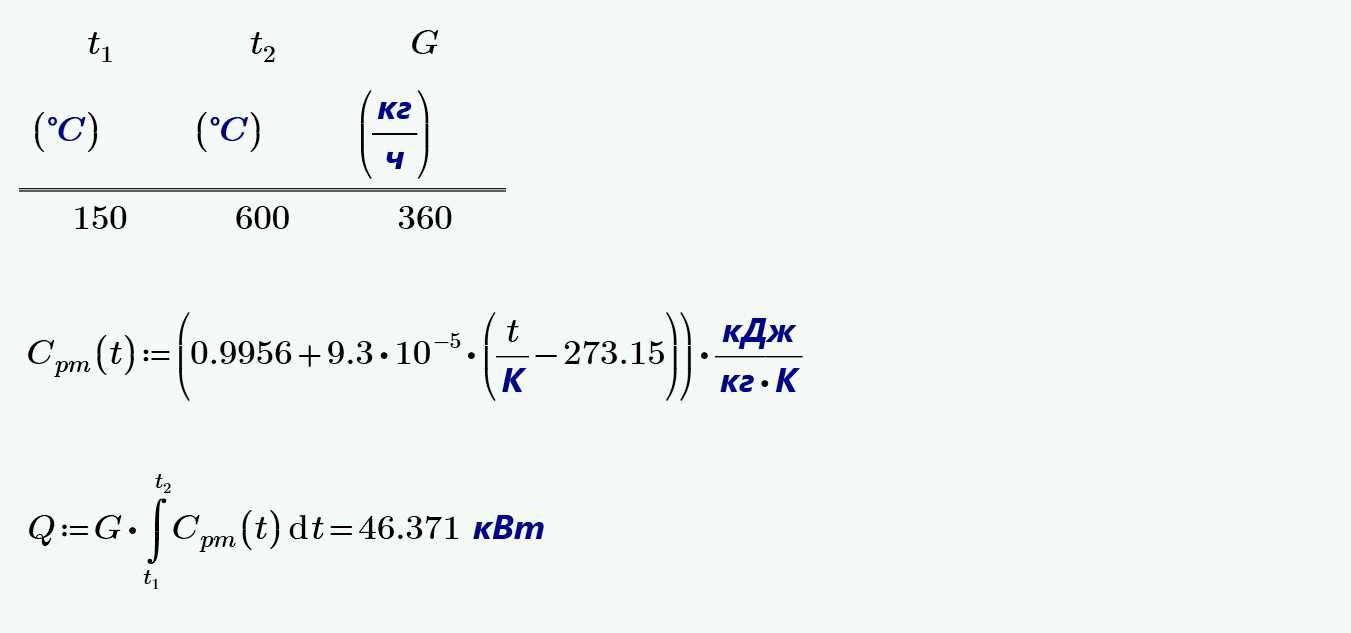



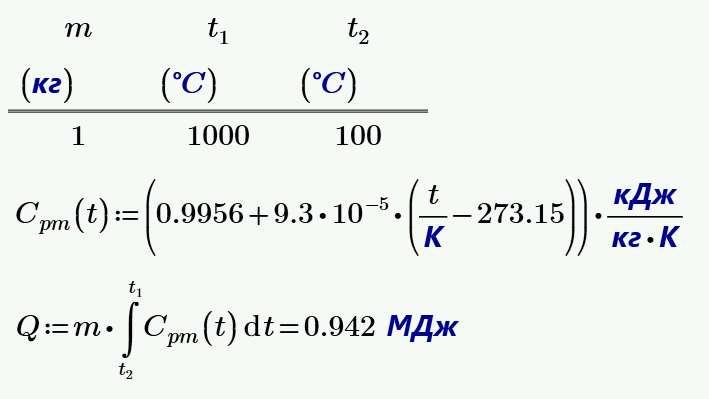
Похожие статьи
- Как приготовить из козий молока сыр домашних условиях - Сыр из козьего молока в домашних условиях: д
- Урок прически для девочек - Прически для девочек: 100 новых фото и пошаговые уроки
- Как сделать простой радиоприемник в домашних условиях
- Как заплести легкие прически самой себе - Коллекция красивых причесок и мастер классов / как